| 7.4 Formulación de la ecuación cinética
La ecuación cinética expresa la velocidad en función de concentraciones de las sustancias o de factores relacionados con el transporte.
Reacciones elementales: Generación de productos a través de
una interacción entre las moléculas de reactivos en una sola etapa.
Reacciones no elementales: Generación de productos a través de
un conjunto de etapas de reacción en las que aparecen compuestos
intermedios.
Mecanismo de reacción: Conjunto de etapas de reacción individuales consideradas como reacciones elementales; las etapas
pueden desarrollarse de forma consecutiva (en serie) o de forma
competitiva (en paralelo).
Etapa controlante (limitante): Etapa más lenta de un mecanismo,
que determina la velocidad del proceso global (puede ser una etapa
física en los sistemas heterogéneos).
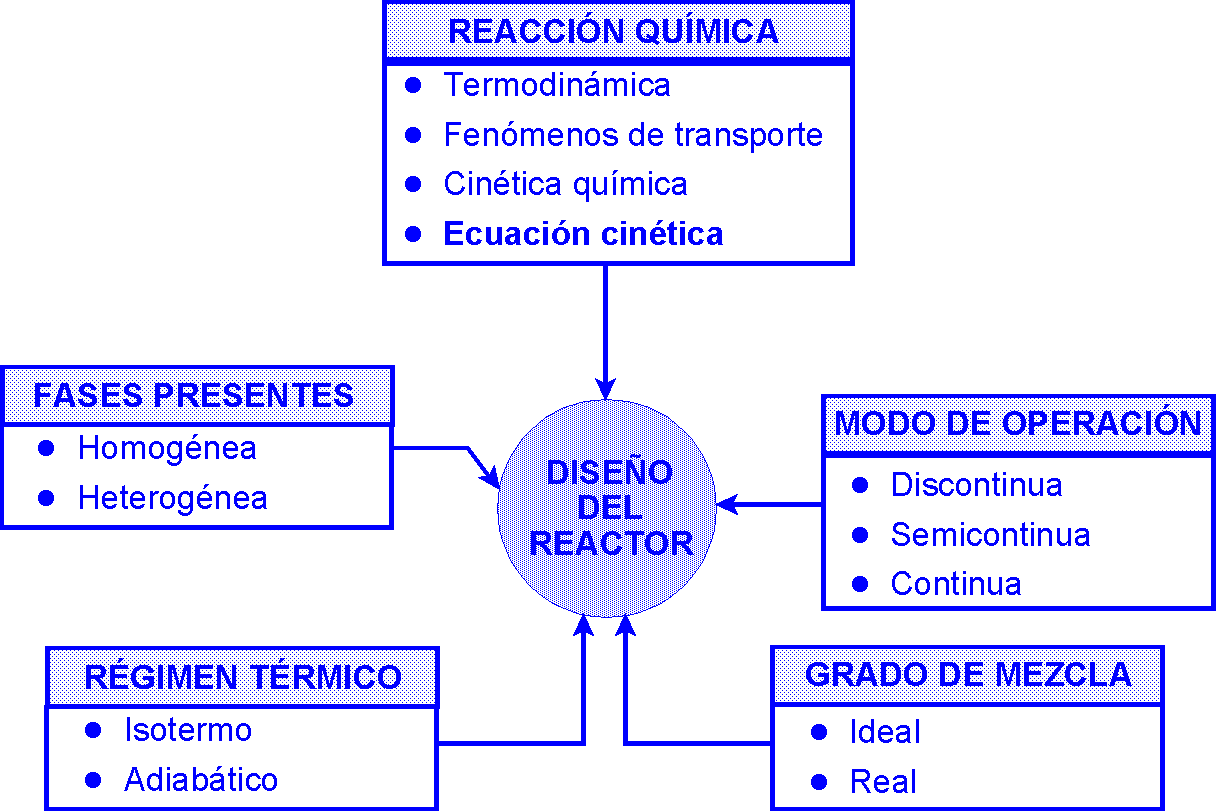
Objetivo del diseño: Determinar una ecuación cinética aplicable
para diseñar el reactor (el mecanismo no interesa, pero podría ser
útil).
Formulación de la ecuación cinética: Conocimiento de los valores
numéricos de los parámetros (coeficiente cinético y órdenes de
reacción) determinados experimentalmente por:
- Ajuste a ecuaciones cinéticas enunciadas empíricamente.
- Ajuste a ecuaciones cinéticas emanadas de modelos de
reacción o de transporte-reacción.
|